Механизм ИКСИ
ИКСИ имеет очень долгую историю. Первоначально механизм был отработан на яйцеклетках золотистого хомячка и впервые описан одним из самых влиятельных ученых-репродуктологов прошлого века – доктором Рузо Янагимачи. О первом успешном оплодотворении человека с помощью инъекции спермы сообщила доктор Сьюзан Ланцендорф. Однако о первой беременности и родах сообщил доктор Янпьеро Палермо, который усовершенствовал эту технику и сделал ее клинически полезной, что поистине произвело революцию в области ЭКО. Большинство элементов механизма ИКСИ были разъяснены доктором Дмитрием Дозорцевым и доктором Андреем Рыбушкиным.
После «перерубания хвоста» сперматозоид становится неподвижным
Механизм оплодотворения после ИКСИ заметно отличается от такового при естественном оплодотворении. Во время нормального процесса оплодотворения за слиянием сперматозоидов и ооцитов следует включение в цитоплазму безмембранного, «голого» ядра сперматозоида, которое сразу же становится доступным для ооплазматических факторов, особенно агентов, снижающих тиол (Perreault et al., 1984). После ИКСИ не обнаженное ядро сперматозоида, а весь сперматозоид подвергается воздействию ооплазмы (Palermo et al., 1991). Было продемонстрировано, что цельные сперматозоиды ведут себя иначе, чем частично лишенные мембраны сперматозоиды (Maleszewski, 1990). Если интактный сперматозоид ввести в ооплазму, взаимодействия между сперматозоидом и ооцитом не будет. Это связано с тем, что ооплазма не имеет фермента для переваривания мембраны сперматозоида, чтобы обеспечить взаимодействие. Следовательно, перед оплодотворением необходимо повредить плазматическую мембрану сперматозоидов. Несмотря на то, что у сперматозоидов есть отличительные отделы, такие как голова, средняя часть и хвост, у них есть только одна плазматическая мембрана, покрывающая всю клетку. Следовательно, плазматическая мембрана сперматозоидов может быть повреждена в любой области, чтобы обеспечить взаимодействие сперматозоидов с яйцеклеткой после инъекции. Обычно во время ИКСИ плазматическая мембрана сперматозоидов повреждается “касанием” хвоста. Мы прижимает хвост сперматозоида стеклянной пипеткой до тех пор, пока повреждение мембраны сперматозоидов не станет достаточным для того, чтобы мембрана потеряла способность поддерживать целостность клетки. Это приводит к отключению насоса Na / K и потере мембранного потенциала. Для наблюдателя это событие отмечается прекращением движения сперматозоидов.
Эффект повреждения плазматической мембраны сперматозоидов может быть достигнут путем замораживания-оттаивания сперматозоидов без криопротектора, разрезания хвоста сперматозоида лазером или механического отделения головки сперматозоида.
Повреждение плазматической мембраны, вызванное «касанием» хвоста, не позволяет внутреннему содержимому сперматозоидов «просачиваться» в окружающую среду. Действительно, сперматозоиды сохраняют полную способность оплодотворять ооцит в течение нескольких часов после иммобилизации.

Наличие ПВП во время иммобилизации сперматозоидов
PVP добавляется в каплю со сперматозоидами, чтобы замедлить их движение и предотвратить прилипание к стеклянной пипетке, используемой для инъекции. Он также образует пленку вокруг плазматической мембраны сперматозоидов и предотвращает взаимодействие между ядром сперматозоида и окружающей средой. Это можно легко продемонстрировать путем иммобилизации сперматозоидов в присутствии как PVP, так и эозина. Эозин обычно используется для определения жизнеспособности сперматозоидов, поскольку неповрежденная плазматическая мембрана исключает окрашивание. Поврежденная плазматическая мембрана становится проницаемой для эозина, который быстро окрашивает ядро в ярко-красный цвет.
Когда сперматозоиды иммобилизуются путем «касания хвоста» в присутствии как PVP, так и эозина, они не поглощают эозин, несмотря на повреждение плазматической мембраны, из-за пленки, образованной PVP вокруг плазматической мембраны. Повреждение плазматической мембраны становится очевидным только после значительного разбавления ПВП.
PVP предотвращает не только окрашивание эозином, но и деконденсацию ядер сперматозоидов in vitro с помощью DTT, очень мощного восстанавливающего тиол агента, по тому же механизму. Следовательно, избыток ПВП, введенного в ооцит во время ИКСИ, может задержать или предотвратить оплодотворение.




После инъекции спермы в ооцит
Плотная упаковка ДНК в ядре сперматозоидов достигается за счет замены гистонов протаминами с последующим образованием дисульфидных связей между ними во время созревания сперматозоидов. Эти дисульфидные связи должны быть восстановлены после оплодотворения, чтобы позволить деконденсации ДНК сперматозоидов и образованию мужского пронуклеуса.
Было ясно показано, что глутатион ( GSH ) является редуктором дисульфидных связей, присутствующим в цитоплазме ооцитов (Perreault et al. 1984 , 1988 ).
Ооциты могут синтезировать GSH (трипептид-глутамил-цистеинил-глицин; GSH) во время первого мейоза. GSH, полученный из ооцитов, по-видимому, обеспечивает восстановление дисульфидных связей в ядрах сперматозоидов. Это, в свою очередь, способствует ядерной деконденсации для образования мужских пронуклеусов во время оплодотворения (обзор Sutovsky & Schatten 1997 ). Таким образом, GSH обеспечивает восстанавливающую способность для инициации деконденсации хроматина до образования мужского пронуклеуса ( Yoshida et al. 1993 ). Истощение эндогенного GSH специфическим ингибитором синтеза GSH во время созревания ооцитов крупного рогатого скота блокирует образование мужского пронуклеуса и предотвращает сборку микротрубочек сперматозоидов (Sutovsky & Schatten 1997). Повышенный уровень GSH в ооцитах может усилить образование пронуклеусов у мужчин после ЭКО (Funahashi et al. 1994 ).
Убедительные доказательства указывают на отсутствие участия протеазы, связанной с ядром сперматозоидов, в набухании ядра ( Perreault and Zirkin, 1982 ).
Ядерное набухание сперматозоидов происходит как после естественного оплодотворения, так и после ИКСИ. После ИКСИ, как только PVP вымывается, GSH может проникать в ядро сперматозоидов и вызывать набухание. Это происходит независимо от активации ооцитов, до самой активации.
Весьма вероятно, что такое набухание разрывает мембрану сперматозоидов, обеспечивая прямой контакт между PLC Zeta и ооплазмой, что приводит к активации ооцита. С этого момента механизм естественного оплодотворения и ИКСИ становится идентичным.

После активации
В отличие от набухания ядер сперматозоидов, которое не зависит от активации ооцитов, все последующие ядерные трансформации сперматозоидов и ядерного материала ооцитов требуют активации ооцитов и, как следствие, снижения активности киназы p34 (cdc2) .
Прежде чем может начаться деконденсация, хромосомы как сперматозоидов, так и яйцеклетки должны конденсироваться и достичь «стадии хроматиновой массы». Весьма вероятно, что этот этап необходим для достижения синхронизации хроматина сперматозоидов и ооцитов перед деконденсацией.
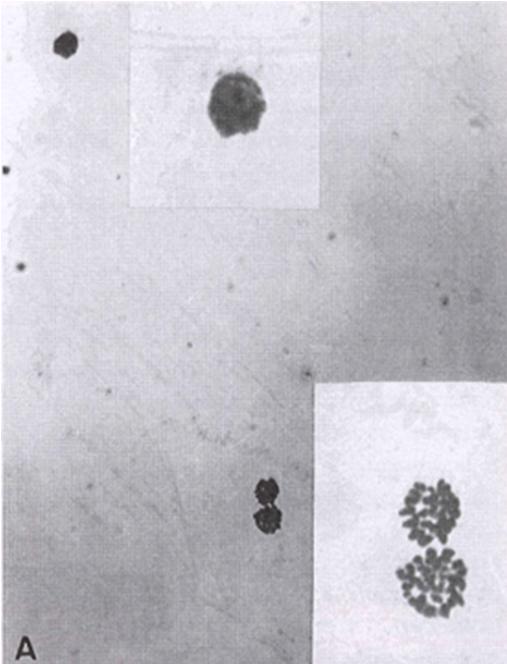
Ранняя телофаза примерно через 4,5 часа после инъекции. Обратите внимание, что на этом этапе ядро сперматозоида не деконденсируется, а остается набухшим. Также обратите внимание, что хромосомы ооцита и полярного тельца образуют две группы, неотличимые друг от друга.

Поздняя телофаза (также известная как стадия массы хроматина) вскоре после экструзии 1PB в однодневном ооците человека. Хроматин сперматозоидов остается набухшим, а хромосомы ооцитов плотно упакованы. На этом этапе хромосомы ооцитов и сперматозоидов синхронизируются перед деконденсацией.
Асинхронность трансформации хромосом сперматозоидов и ооцитов может приводить к образованию одного пронуклеуса. Такая асинхронность после ИКСИ может быть вызвана техническими ошибками инъекции, такими как чрезмерное количество PVP, введенного вместе со сперматозоидом. Поскольку факторы ооцитов, необходимые для образования пронуклеуса, существуют в цитоплазме только в течение относительно короткого периода времени, любые значительные препятствия для взаимодействия сперматозоидов и ооплазмы после инъекции сперматозоидов могут привести к тому, что в ядре сперматозоида не будет окна деконденсации и не будет образовываться пронуклеус.
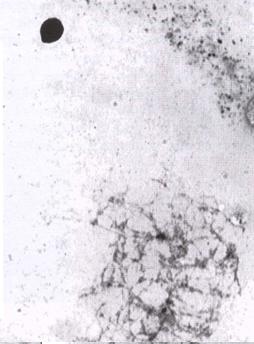
В этом человеческом ооците на следующий день после ИКСИ был обнаружен единственный пронуклеус. Головка сперматозоида опухла, что указывает на то, что она была введена правильно и вступила во взаимодействие с ооцитом, что привело к активации. Однако по неизвестным причинам он не деконденсировался. Полученный гаплоидный эмбрион будет нежизнеспособным.
Активация ооцитов после ИКСИ
Идея о том, что активация ооцитов после или во время ИКСИ запускается уколом иглой, пришла из более ранних экспериментов с ооцитами хомяка, которые действительно могут быть активированы таким образом. Поэтому была использована интенсивная аспирация ооплазмы в попытке улучшить скорость оплодотворения.
Однако последующие данные на людях продемонстрировали, что даже несмотря на то, что инъекция культуральной среды без сперматозоидов с помощью пипетки для ИКСИ вызывает кратковременное повышение уровня свободного внутриклеточного кальция, это не приводит к активации ооцитов. Значит сперматозоиды ответственны за активацию после ИКСИ. Дальнейшие исследования показали, что предполагаемый активирующий фактор из сперматозоидов человека может быть отделен от основной массы сперматозоидов и является цитозольным, термочувствительным и не видоспецифичным. Впоследствии он был идентифицирован как PLC Zeta. Сперматозоиды, лишенные PLC Zeta, не могут активировать ооциты .
Интересно отметить, что даже несмотря на то, что интенсивная аспирация ооплазмы не может значительно улучшить показатели оплодотворения, она может быть полезна в тех случаях, когда после инъекции вокруг головки сперматозоида появляется видимая вакуоль. Эта вакуоль может предотвращать взаимодействие сперматозоидов с ооцитами, тем самым предотвращая высвобождение PLC Zeta и активацию ооцитов.
Расположение активирующего фактора в сперматозоиде
Активирующий фактор, ответственный за активацию ооцитов, находится в экваториальной области сперматозоидов человека. Несмотря на то, что осциллин находится в цитозольной фракции, значительное его количество связано с ядерной мембраной сперматозоида. Тот факт, что осциллин мигрирует в пронуклеусы после оплодотворения, также предполагает его ядерное сродство.
После полного разрушения плазматической мембраны сперматозоидов в результате механического отделения головки сперматозоида не происходит заметного снижения активирующего потенциала головки сперматозоида после нескольких часов инкубации. В то же время после интрацитоплазматической инъекции активирующий фактор высвобождается в течение нескольких минут. Это указывает на то, что высвобождение PLC Zeta из сперматозоидов является активным процессом, который требует взаимодействия сперматозоида и ооплазмы.
Механизм оплодотворения после ИКСИ
В то время как глутатион отвечает за восстановление дисульфидных связей и его действие ограничивается независимым от активации ооцитов набуханием ядра сперматозоидов, SNDF требуется для последующей деконденсации ДНК (требует активации ооцитов), приводящей к образованию мужских пронуклеусов. Точная природа SNDF неизвестна, хотя было установлено, что она происходит из ядерного материала GV .

Появление PLC Zeta во время созревания сперматозоидов
На стадии круглой сперматиды мужской геном редуцируется до гаплоидного состояния и способен поддерживать полноценное развитие. Время, когда PLC Zeta впервые появляется в сперматогенных клетках, кажется, варьирует от вида к виду. Ядзава и др. изучили это, вводя сперматиды на разных стадиях спермиогенеза (разных видов) в зрелые яйца мышей (как универсальных реципиентов). Они обнаружили, что время, когда фактор впервые появляется, у разных видов разное.
Отсутствие успеха при оплодотворении с использованием круглых сперматид (по крайней мере, в некоторых случаях) может быть связано с неспособностью вызвать повреждение плазматической мембраны до инъекции. Использование пьезоинжектора для повреждения плазматической мембраны круглых сперматид кажется наиболее эффективным способом добиться этого.
Однако свидетельства того, что круглые сперматиды способны активировать ооцит после инъекции, могут быть подвергнуты сомнению. Утверждается, что из-за неоднозначности в идентификации предшественников сперматозоидов при приготовлении образцов яичек для инъекций выбираются незрелые сперматозоиды, а не сперматиды. В них отсутствует фактор активации ооцитов, так как PLC Zeta присутствует только у полностью созревших сперматозоидов.
Морфология сперматозоида и его активирующая способность
Недавно овулировавшие человеческие ооциты чрезвычайно устойчивы к партеногенетической активации. Таким образом, даже если частота оплодотворения низкая, это указывает на присутствие PLC Zeta в сперматозоидах.
В большинстве случаев неудачу оплодотворения можно ожидать на основании морфологии сперматозоидов. Крайне маловероятно, что морфологически нормальный живой (подвижный) сперматозоид не сможет активировать ооцит из-за дефицита активирующего фактора. Если в этом случае активация не удалась, это, вероятно, связано с ооцитом. В то же время морфологическая оценка сперматозоидов не всегда позволяет предсказать их активирующий потенциал.
Например, безакросомные (глобоспермические) сперматозоиды в некоторых случаях успешно активируют ооциты человека (Stone et al., 2000 , Dirican et al., 2008), в то время как в других случаях их инъекция приводит к 100% неудачной активации. Это может до некоторой степени коррелировать с акрозин-положительным или акрозин-отрицательным статусом сперматозоидов, что, в свою очередь, может коррелировать с отсутствием PLC Zeta.
При синдроме Картагенера неудача оплодотворения после ИКСИ, скорее всего, связана с трудностями выбора живого сперматозоида для инъекции, а не с отсутствием активирующего фактора.
Чувствительность ооцитов к PLC Zeta меняется со временем
Было показано на мышах и позже подтверждено обширным опытом на людях, что ооциты MII постепенно развивают способность к оплодотворению. Эта способность появляется значительно позже и не зависит от способности сливаться со сперматозоидом.
Ооцит, подвергнутый инъекции или инсеминации до того, как он достиг цитоплазматической зрелости, подвергнется некоторой форме абортивной активации, при этом ядро сперматозоида образует так называемую преждевременную конденсацию хромосом (PCC), а ооцит продвигается к так называемой MIII .
У мышей активация требует наличия неповрежденного веретена, хотя это явление зависит от штамма. У людей также было показано, что наличие веретена коррелирует с оплодотворением.
Чувствительность к PLC Zeta, определяемая скоростью оплодотворения, непрерывно увеличивается со временем, прошедшим после введения ХГЧ, достигая пика через 41 час после введения ХГЧ. Хотя самая высокая скорость имплантации была достигнута, когда ИКСИ проводилась между 37 и 41 часами после ХГЧ. Это может быть объяснено скоростью хромосомных аберраций, которая, как было показано, коррелирует с возрастом ооцита на момент инсеминации у мышей, хотя другие метаболические факторы, вероятно, также играют роль.
Чувствительность ооцитов к PLC Zeta, хотя и сниженная, сохраняется более 61 часа после ХГЧ, но полученные эмбрионы имеют чрезвычайно низкий потенциал к имплантации.
Определение сперматозоидов в образце яичек
Биопсия яичка, тонкоигольная аспирация и микродиссекция отдельных канальцев могут дать подвижные жизнеспособные сперматозоиды для ИКСИ. Идентификация жизнеспособных сперматозоидов в препарате гомогенизированных канальцев требует сортировки по множеству типов клеток, общих для канальцев яичка, чтобы найти наиболее подходящие сперматозоиды для инъекции. Сперматозоиды отбираются в первую очередь по подвижности, а во вторую – по морфологии. Сперматозоиды яичек незрелые, и их подвижность может проявляться в виде медленных или быстрых непрогрессирующих подергиваний, а иногда и в виде подвижности с прогрессированием вперед.
Идентифицировать сперматозоиды в препарате легче, когда плотность сперматозоидов, отражающая сперматогенез, в большей части ткани семенников нормальна; однако бывают случаи, когда сперматогенез не согласован по всем канальцам, и ткань демонстрирует мозаичный узор морфологии канальцев. В этом случае отдельные канальцы могут быть оценены во время микродиссекции, или ткань яичек может сопоставляться с помощью сеточного подхода, путем множественных аспираций тонкой иглой для определения местоположения отдельных очагов сперматогенеза. После этого можно исследовать конкретные области сперматогенеза. Отдельные канальцы, которые с большей вероятностью будут иметь участки, содержащие сперматозоиды, будут больше в диаметре и непрозрачны по сравнению с участками без активного сперматогенеза, и существует большая вероятность сперматогенеза в канальцах ближе к кровоснабжению.
Крупным планом – семенные канальцы и кровоснабжение канальцев
Ткань яичек можно получить на месте рядом с лабораторией ЭКО или за ее пределами и доставить в лабораторию ЭКО. Кроме того, ткань может быть собрана в тот же день, что и пункция ооцитов, или перед пункцией ооцитов и, например , выдержана в культуре в течение ночи. Может быть криоконсервирована и сохранена в жидком азоте до тех пор, пока это не понадобится.
Канальцы яичка можно обрабатывать различными методами. Хотя это требует времени, отдельные канальцы можно раздавливать, когда канальцы визуализируются под микроскопом для препарирования. Для этого используется не режущий инструмент. Например, закругленный край стеклянной пипетки или предметное стекло сдвигается вниз и проводится по длине канальца, выталкивая содержимое канальца с одного конца. Этот процесс повторяется по мере необходимости. Объемные канальцы можно гомогенизировать, используя иглы и/или лезвия скальпеля, или используя стерильную ступку и гомогенизаторы ткани типа пестика. Гомогенат можно собрать в среде и центрифугировать, чтобы сконцентрировать содержимое канальцев для исследования. Ферментативное применение может повысить эффективность процедуры, увеличивая выход жизнеспособных сперматозоидов у лиц со сниженным сперматогенезом.
При активном сперматогенезе клетки в гомогенате будут представлены типами сперматозоидов и других клеток. Причем наиболее легко идентифицируемыми типами клеток являются зрелые сперматозоиды и красные кровяные тельца, которые загрязняют препарат. Движение может исходить от самого сперматозоида или косвенно от столкновения или отталкивания сперматозоидов от других клеток, или движения более крупных скоплений клеток от незрелых сперматозоидов, пока они еще прикреплены к клеткам. Это также может быть связано с наличием клеток из vasa efferentia или эпителиальных клеток проксимального отдела головки (S. Silber, не опубликовано). Эти клетки имеют реснички, которые выводят сперматозоиды из яичка в придаток яичка. Из-за неполного разделения сперматид это могут быть многохвостые сперматозоиды в ткани канальцев. Подводя подозреваемые многохвостые сперматозоиды к дну чашки с помощью микропипетки, можно распутать их хвосты. Морфология незрелых сперматозоидов может заметно отличаться от клеток в эякуляте. В частности, проксимальные капли могут быть более выраженными, поскольку остаточная цитоплазма еще не уменьшилась. Кроме того, могут быть обнаружены удлиненные сперматиды с полным образованием хвоста, но у которых головка сперматозоида все еще заключена в цитоплазму. И если нет зрелых сперматозоидов, можно рассмотреть эти сперматиды.
Нормальный сперматогенез в образце яичек
Ошибочная идентификация клеток как подвижных сперматозоидов в образце яичек
Иногда при первоначальном наблюдении в операционной отмечается подвижная сперма. Однако тщательное обследование в репродуктивной лаборатории с помощью более мощного инвертированного микроскопа позволяет сделать более точное определение. В этом случае «движущаяся клетка», изначально ошибочно идентифицированная как подвижный сперматозоид, впоследствии была правильно идентифицирована Dr. Silber как vasa efferentia или проксимальная эпителиальная клетка головки .
Сперматогенез и типы клеток-предшественников
Правильная идентификация различных типов клеток, представляющих ранние стадии сперматогенеза в свежем препарате, является более сложной задачей. Когда зрелые сперматозоиды не идентифицируются при подготовке яичка, более ранние стадии могут быть идентифицированы и рассмотрены для ИКСИ. Но для большинства персонала ЭКО эта практика должна быть ограничена идентификацией и использованием удлиненных сперматид, где есть видимый, очевидный хвост сперматозоида. Рассматривается возможность использования гаплоидных клеток-предшественников сперматозоидов на людях (см. Обзор Yanagimachi, 2005).), однако очень трудно отличить гаплоидные круглые сперматиды от диплоидных круглых клеток-предшественников. Поэтому Американское общество репродуктивной медицины и Комитеты по практике вспомогательной репродукции заявили в совместном отчете, что ROSNI (или ROSI) следует рассматривать только в соответствии с утвержденными экспериментальными протоколами (ASRM, 2008). Для получения дополнительной информации об идентификации различных типов клеток, присутствующих в препарате яичек, есть две отличные статьи, в которых описываются стадии сперматогенеза человека и представлены фотографии как фиксированных, так и живых клеток. Обе статьи находятся в свободном доступе на соответствующих веб-сайтах журналов (Johnson et al, 1999 , 2001, Silber и др., 1997 ).
Основа искусственной активации
Развитие эмбрионов может быть стимулировано с помощью различных активаторов: ионофор кальция A23187, CaCl2, SrCl2. Большинство, но не все, стимулы, которые вызывают активацию ооцитов у мышей, также могут применяться у людей. Этиловый спирт, очень мощный активатор ооцитов мышей, не способен вызывать активацию ооцитов человека даже первого дня (Dyban et al, неопубликовано).
Почти все физические и химические активирующие стимулы, используемые для искусственной активации у людей, вызывают высвобождение Са++ в цитоплазму, имитируя в разной степени высвобождение Са++, происходящее во время естественного оплодотворения.
Конечной точкой активации любым активирующим агентом, вызывающим высвобождение Са++, является физическое разрушение циклина B1, что приводит к инактивации киназы p34 и снижению активности фактора стимулирования созревания (MPF), также известного как цитостатический фактор (CSF) ( Hyslop et al, 2004 г.).
Отдельно стоит упомянуть об одном из сильнодействующих искусственных активирующих агентов ооцитов человека – пуромицине. Это связано с тем, что он не вызывает высвобождение Са++ и, вероятно, действует путем подавления синтеза циклина В и ингибирования его фосфорилирования, а не путем его физического разрушения. Точкой невозврата в ооцитах, активированных пуромицином, скорее всего, является начало синтеза ДНК.
Это наблюдение имеет практическое значение, поскольку оно предсказывает, что пуромицин будет действовать синергетически с Са++, задействуя стимулы активации.
Чувствительность к партеногенетической активации ооцитов человека самая низкая сразу после овуляции и постоянно увеличивается с течением времени. Природа активационного стимула не имеет решающего значения для последующего развития эмбриона.